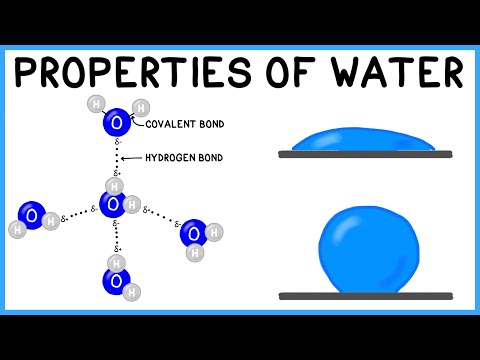
ਦੋਵੇਂ ਰਸਾਇਣਕ ਮਿਸ਼ਰਣ ਜਿਵੇਂ ਕਿ ਰਸਾਇਣਕ ਤੱਤ ਅਣੂਆਂ ਦੇ ਬਣੇ ਹੁੰਦੇ ਹਨ, ਅਤੇ ਇਹ ਬਦਲੇ ਵਿੱਚ ਪਰਮਾਣੂਆਂ ਦੇ ਬਣੇ ਹੁੰਦੇ ਹਨ. ਪਰਮਾਣੂ ਅਖੌਤੀ ਦੇ ਗਠਨ ਦੇ ਲਈ ਇੱਕਜੁਟ ਰਹਿੰਦੇ ਹਨ ਰਸਾਇਣਕ ਸੰਬੰਧ.
ਦੇ ਰਸਾਇਣਕ ਬੰਧਨ ਸਾਰੇ ਇੱਕੋ ਜਿਹੇ ਨਹੀਂ ਹੁੰਦੇ: ਅਸਲ ਵਿੱਚ ਉਹ ਸ਼ਾਮਲ ਪਰਮਾਣੂਆਂ ਦੀਆਂ ਇਲੈਕਟ੍ਰੌਨਿਕ ਵਿਸ਼ੇਸ਼ਤਾਵਾਂ ਤੇ ਨਿਰਭਰ ਕਰਦੇ ਹਨ. ਲਿੰਕ ਦੀਆਂ ਦੋ ਸਭ ਤੋਂ ਆਮ ਕਿਸਮਾਂ ਹਨ: ionic ਬੰਧਨ ਅਤੇ ਸਹਿਮਤੀ ਬਾਂਡ.
ਆਮ ਤੌਰ 'ਤੇ, ਸਹਿਯੋਗੀ ਬਾਂਡ ਉਹ ਹੁੰਦੇ ਹਨ ਗੈਰ-ਧਾਤੂ ਪਰਮਾਣੂਆਂ ਨੂੰ ਇਕੱਠੇ ਰੱਖੋ. ਇਹ ਵਾਪਰਦਾ ਹੈ ਕਿ ਇਹਨਾਂ ਤੱਤਾਂ ਦੇ ਪਰਮਾਣੂਆਂ ਦੇ ਬਾਹਰਲੇ ਸ਼ੈੱਲ ਵਿੱਚ ਬਹੁਤ ਸਾਰੇ ਇਲੈਕਟ੍ਰੌਨ ਹੁੰਦੇ ਹਨ ਅਤੇ ਉਹਨਾਂ ਨੂੰ ਛੱਡਣ ਦੀ ਬਜਾਏ ਇਲੈਕਟ੍ਰੌਨ ਨੂੰ ਬਰਕਰਾਰ ਰੱਖਣ ਜਾਂ ਪ੍ਰਾਪਤ ਕਰਨ ਦੀ ਪ੍ਰਵਿਰਤੀ ਹੁੰਦੀ ਹੈ.
ਇਹੀ ਕਾਰਨ ਹੈ ਕਿ ਜਿਸ ਤਰੀਕੇ ਨਾਲ ਇਹ ਪਦਾਰਥ ਜਾਂ ਰਸਾਇਣਕ ਮਿਸ਼ਰਣਆਈਕੋਸ ਸਥਿਰਤਾ ਪ੍ਰਾਪਤ ਕਰਦਾ ਹੈ ਇਲੈਕਟ੍ਰੌਨਾਂ ਦੀ ਇੱਕ ਜੋੜੀ ਨੂੰ ਸਾਂਝਾ ਕਰਕੇ, ਯੂਹਰ ਪਰਮਾਣੂ ਤੋਂ ਨਹੀਂ. ਇਸ ਤਰ੍ਹਾਂ ਇਲੈਕਟ੍ਰੌਨਾਂ ਦੀ ਸਾਂਝੀ ਜੋੜੀ ਦੋ ਪਰਮਾਣੂਆਂ ਲਈ ਸਾਂਝੀ ਹੈ ਅਤੇ ਉਸੇ ਸਮੇਂ ਉਨ੍ਹਾਂ ਨੂੰ ਇਕੱਠੇ ਰੱਖਦੀ ਹੈ. ਵਿੱਚ ਗੈਸਾਂ ਰਈਸ, ਉਦਾਹਰਣ ਵਜੋਂ, ਇਹ ਵਾਪਰਦਾ ਹੈ. ਹੈਲੋਜਨ ਤੱਤ ਵਿੱਚ ਵੀ.
ਜਦੋਂ ਸਹਿਯੋਗੀ ਬਾਂਡ ਸਮਾਨ ਇਲੈਕਟ੍ਰੋਨੈਗੇਟਿਵਿਟੀ ਦੇ ਤੱਤਾਂ ਦੇ ਵਿਚਕਾਰ ਹੁੰਦਾ ਹੈ, ਜਿਵੇਂ ਕਿ ਹਾਈਡ੍ਰੋਜਨ ਅਤੇ ਕਾਰਬਨ ਦੇ ਵਿਚਕਾਰ, ਇੱਕ ਬੰਧਨ ਪੈਦਾ ਹੁੰਦਾ ਹੈ ਅਪੋਲਰ ਸਹਿਯੋਗੀ. ਇਹ ਵਾਪਰਦਾ ਹੈ, ਉਦਾਹਰਣ ਵਜੋਂ, ਹਾਈਡਰੋਕਾਰਬਨ ਵਿੱਚ.
ਇਸੇ ਤਰ੍ਹਾਂ, ਸਮਲਿੰਗੀ ਅਣੂ (ਇੱਕੋ ਪਰਮਾਣੂ ਦੇ ਬਣੇ) ਹਮੇਸ਼ਾਂ ਬਣਦੇ ਹਨ ਅਪੋਲਰ ਬੰਧਨ. ਪਰ ਜੇ ਬਾਂਡ ਵੱਖੋ -ਵੱਖਰੇ ਇਲੈਕਟ੍ਰੋਨੈਗੇਟਿਵਿਟੀ ਦੇ ਤੱਤਾਂ ਦੇ ਵਿਚਕਾਰ ਹੁੰਦਾ ਹੈ, ਤਾਂ ਇੱਕ ਉੱਚ ਇਲੈਕਟ੍ਰੌਨ ਘਣਤਾ ਦੂਜੇ ਦੇ ਮੁਕਾਬਲੇ ਇੱਕ ਐਟਮ ਵਿੱਚ ਪੈਦਾ ਹੁੰਦੀ ਹੈ, ਇਸਦੇ ਨਤੀਜੇ ਵਜੋਂ ਇੱਕ ਧਰੁਵ ਬਣਦਾ ਹੈ.
ਤੀਜੀ ਸੰਭਾਵਨਾ ਇਹ ਹੈ ਕਿ ਦੋ ਪਰਮਾਣੂ ਇਲੈਕਟ੍ਰੌਨਾਂ ਦੀ ਇੱਕ ਜੋੜੀ ਨੂੰ ਸਾਂਝਾ ਕਰਦੇ ਹਨ, ਪਰ ਇਹ ਕਿ ਇਹਨਾਂ ਸਾਂਝੇ ਇਲੈਕਟ੍ਰੌਨਾਂ ਦਾ ਯੋਗਦਾਨ ਉਹਨਾਂ ਵਿੱਚੋਂ ਸਿਰਫ ਇੱਕ ਪਰਮਾਣੂ ਦੁਆਰਾ ਹੁੰਦਾ ਹੈ. ਉਸ ਸਥਿਤੀ ਵਿੱਚ ਅਸੀਂ ਗੱਲ ਕਰਦੇ ਹਾਂ ਪਰਿਵਰਤਨਸ਼ੀਲ ਜਾਂ ਸਹਿਯੋਗੀ ਬੰਧਨ.
ਏ ਲਈ ਪਰਿਭਾਸ਼ਿਤ ਲਿੰਕ ਤੁਹਾਨੂੰ ਇੱਕ ਮੁਫਤ ਇਲੈਕਟ੍ਰੌਨ ਜੋੜਾ (ਜਿਵੇਂ ਨਾਈਟ੍ਰੋਜਨ) ਵਾਲਾ ਇੱਕ ਤੱਤ ਚਾਹੀਦਾ ਹੈ ਅਤੇ ਦੂਜਾ ਇਲੈਕਟ੍ਰੌਨ ਦੀ ਘਾਟ ਵਾਲਾ (ਜਿਵੇਂ ਹਾਈਡ੍ਰੋਜਨ). ਇਹ ਵੀ ਜਰੂਰੀ ਹੈ ਕਿ ਇਲੈਕਟ੍ਰੌਨਿਕ ਜੋੜੀ ਵਾਲਾ ਇਲੈਕਟ੍ਰੌਨਗੇਟਿਵ ਹੋਵੇ ਤਾਂ ਜੋ ਇਲੈਕਟ੍ਰੌਨਸ ਨੂੰ ਸਾਂਝਾ ਕਰਨ ਲਈ ਨਾ ਗੁਆਏ. ਇਹ ਸਥਿਤੀ ਵਾਪਰਦੀ ਹੈ, ਉਦਾਹਰਣ ਵਜੋਂ, ਅਮੋਨੀਆ (ਐਨਐਚ 4) ਵਿੱਚ+).
ਦੇ ਪਦਾਰਥ ਸਹਿਯੋਗੀ ਮਿਸ਼ਰਣ ਰੱਖਣ ਵਾਲੇ ਪਦਾਰਥ ਦੀ ਕਿਸੇ ਵੀ ਅਵਸਥਾ (ਠੋਸ, ਤਰਲ ਜਾਂ ਗੈਸੀ) ਅਤੇ ਆਮ ਤੌਰ ਤੇ ਹੋ ਸਕਦੇ ਹਨ ਉਹ ਗਰਮੀ ਅਤੇ ਬਿਜਲੀ ਦੇ ਮਾੜੇ ਕੰਡਕਟਰ ਹਨ.
ਉਹ ਅਕਸਰ ਦਿਖਾਉਂਦੇ ਹਨ ਮੁਕਾਬਲਤਨ ਘੱਟ ਪਿਘਲਣ ਅਤੇ ਉਬਾਲਣ ਦੇ ਅੰਕ ਅਤੇ ਆਮ ਤੌਰ ਤੇ ਪੋਲਰ ਸੌਲਵੈਂਟਸ ਵਿੱਚ ਘੁਲਣਸ਼ੀਲ ਹੁੰਦੇ ਹਨ, ਜਿਵੇਂ ਕਿ ਬੈਂਜ਼ੀਨ ਜਾਂ ਕਾਰਬਨ ਟੈਟਰਾਕਲੋਰਾਈਡ, ਪਰ ਪਾਣੀ ਵਿੱਚ ਘੁਲਣਸ਼ੀਲਤਾ ਘੱਟ ਹੈ. ਉਹ ਬੇਹੱਦ ਸਥਿਰ ਹਨ.
ਸਹਿਯੋਗੀ ਬਾਂਡਾਂ ਵਾਲੇ ਮਿਸ਼ਰਣਾਂ ਜਾਂ ਪਦਾਰਥਾਂ ਦੀਆਂ ਕਈ ਉਦਾਹਰਣਾਂ ਦਿੱਤੀਆਂ ਜਾ ਸਕਦੀਆਂ ਹਨ:
- ਫਲੋਰਾਈਨ
- ਬਰੋਮਾਈਨ
- ਆਇਓਡੀਨ
- ਕਲੋਰੀਨ
- ਆਕਸੀਜਨ
- ਪਾਣੀ
- ਕਾਰਬਨ ਡਾਈਆਕਸਾਈਡ
- ਅਮੋਨੀਆ
- ਮੀਥੇਨ
- ਪ੍ਰੋਪੇਨ
- ਸਿਲਿਕਾ
- ਹੀਰਾ
- ਗ੍ਰੈਫਾਈਟ
- ਕੁਆਰਟਜ਼
- ਗਲੂਕੋਜ਼
- ਪੈਰਾਫ਼ਿਨ
- ਡੀਜ਼ਲ
- ਨਾਈਟ੍ਰੋਜਨ
- ਹੀਲੀਅਮ
- ਫਰੀਓਨ


